新闻动态
Cbz是最常用的氨基保护基之一(式1),其优势在于引入和脱除都很便利,而且Cbz保护基的引入通常使得保护产物易于结晶且稳定性提高,易通过结晶法纯化。
式1
Cbz保护基引入方法较多,最常用的方法是在碱性条件下与氯甲酸苄酯(Cbz-Cl)反应生成N-Cbz保护的氨基化合物(式2),除Cbz-Cl外,N-苄基琥珀酰亚胺碳酸酯Cbz-Osu、4-硝基苯基碳酸苄酯(Cbz-ONB)等活化酯也可用作苄氧羰基的引入试剂。
式2
使用Cbz-Cl在碱性条件下引入Cbz时,通常要控制pH在8~10之间,pH过低会导致Cbz-Cl分解,pH过高则可能会引起氨基酸消旋化。因此,碱在此过程中不仅充当缚酸剂中和产生的HCl,还要维持反应体系pH的稳定,这在规模化生产上具有一定难度。Abell团队开发了一种Na2CO3: NaHCO3=2:1的混合碱缓冲体系,能有效维持pH在8-10范围内,适用于多种手性氨基酸的Cbz保护(式3)。
式3
此外,Sureshbabu团队开发了一种在仲酰胺氮上引入Cbz保护基的便捷方法(式4),在碱LiHMDS(双三甲基硅基氨基锂)的作用下,仲酰胺与Cbz-Cl反应顺利实现N-Cbz保护。
式4
Cbz保护基在非碱性条件下同样可以温和、高效地进行N-Cbz保护。
Cbz-Cl/I2/MeOH
Varala团队开发了一种碘催化的高效引入Cbz保护基的方法,催化量的碘单质充当路易斯酸,在结构和电子特性差异显著的胺类化合物中温和、高效的引入Cbz保护基(式5)。
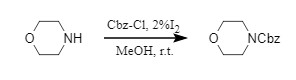
式5
Cbz-Cl/PEG-600
黄海洪教授团队开发了一种高效、环保且具有化学选择性的Cbz保护基引入的方法(式6),该方法以绿色低毒的PEG-600为反应介质,脂肪胺和芳香胺与Cbz-Cl反应,均能以高收率得到相应的N-Cbz衍生物。
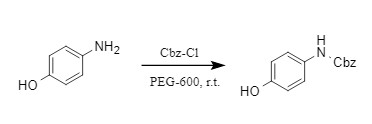
式6
Cbz保护基的脱除方法多样,催化氢解是最主要的脱除方式。在底物含有其他敏感基团时,可考虑在酸性、碱性或其他条件下进行选择性脱保护。
催化氢解包括催化氢化和转移氢化,均适用于Cbz的脱除,通常情况下,在氢源足够时会生成二氧化碳和甲苯;氢源不足的情况下,则会发生副反应,生成N-苄基保护的三级胺。若体系内同时存在Boc2O,可实现N-Cbz保护一步转化成N-Boc衍生物,且苄醚等易还原官能团不受影响(式7)。
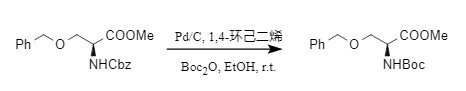
式7
另外,Pd-C/NaBH4/MeOH的组合也是一种便捷的脱Cbz方法(式8),该方法通过现场生成氢气的方式,简单快速的脱除Cbz,且对众多常规保护基兼容性好。
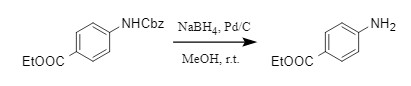
式8
Cbz保护基在酸性条件下也很容易脱除,其中HBr/HOAc是常用的脱Cbz体系(式9),脱保护速度会随HBr浓度增加而加快。
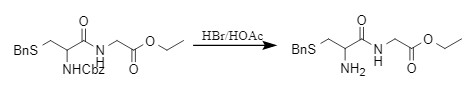
式9
同样的,路易斯酸也可以用于脱N-Cbz保护,AlCl3/HFIP(六氟异丙醇)体系可以在硝基、双键、苄基等敏感基团存在下,温和、安全的选择性脱去Cbz保护,具有很好的底物适用性(式10)。
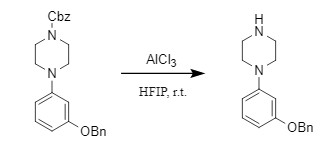
式10
在某些特定环境下,碱性条件也可以实现Cbz保护基的脱除,如对于N,N’-双Cbz保护的二嗪酸化合物可以在碱性条件下选择性脱去一个Cbz保护基(式11)。另外,在较高浓度的氢氧化钠溶液中,卡那霉素A的中间体可以选择性的脱去特定位置如N-3’’位的Cbz保护基。
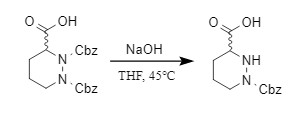
式11
除了上述提到的脱保护方法外,还有许多可以在特定条件下进行N-Cbz脱保护的方法,诸如低级醇(甲醇、乙醇等)可以用于脱去咪唑,吡唑类化合物上的N-Cbz保护基(式12),有机金属试剂如n-Bu3SnH/AIBN体系,可以选择性的脱去酰胺、含氮杂芳环的N-Cbz保护基,而脂肪胺等的Cbz保护不受影响。这些方法可作为常规脱Cbz方法的补充,本文不再详述。
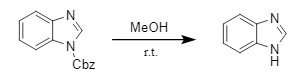
式12
总而言之,上述提到的脱Cbz方法各有优缺点和适合场景,在复杂的有机合成反应中,保护基的引入和脱除需要根据具体反应底物的结构特点选用合适的合成策略。
参考文献:
[1] 徐秋霞. 谷胱甘肽的化学合成研究[D]. 东华大学, 2010.
[2] Pehere, A. D.; Abell, A. D. An improved large scale procedure for the preparation of N-Cbz amino acids [J]. Tetrahedron Lett., 2011, 52, 1493-1494.
[3] Sureshbabu, P.; Azeez, S.; Kandasamy, J., et al. Synthesis of N-Cbz Amides and Their Applications in the Transamidation Reactions at Room Temperature [J]. Asian J. Org. Chem., 2022, 11.
[4] Varala, R.; Enugala, R.; Adapa, S. R.. Molecular Iodine-Catalyzed Efficient N-Cbz Protection of Amines [J]. J. Iran. Chem. Soc., 2007, 4, 370-374.
[5] Zhang, C. L.; Zhang, D. F.; Huang, H. H.; et al. A facile protocol for N-Cbz protection of amines in PEG-600 [J]. Chinese Chemical Letters, 2012, 23, 789-792.
[6] Cameron, M.; Wilson, R. D. The unexpected formation of N-benzylated tertiary amines from their corresponding CBZ-protected precursors [J]. APPL CATAL A-GEN, 2000, 203, 307-310.
[7] Bajwa, J. S. One-Pot Transformation of Benzyl Carbamates into t-Butyl Carbamates[J]. Tetrahedron Lett. 1992, 33, 2955-2956.
[8] Sultane, P. R.; Mete, T. B.; Bhat, R. G. A Convenient Protocol for the Deprotection of N-Benzyloxycarbonyl (Cbz) and Benzyl ester groups[J]. Tetrahedron Lett., 2015, 56, 2067-2070.
[9] Vinayagam, V.; Sadhukhan, S. K.; Kumar, T. V. H.; et al. Mild Method for Deprotection of the NBenzyloxycarbonyl (NCbz) Group by the Combination of AlCl3 and HFIP[J]. J. Org. Chem., 2024, 89, 5665-5674.
[10] Papadaki, E.; Georgiadis, D.; Tsakos, M. A Reliable Enantioselective Route to Mono-Protected N1-Cbz Piperazic Acid Building Block[J]. Molecules, 2020, 25, 5939.
[11] Chen, G. H.; Pan, P.; Li, Z. J.; et al. Selective deprotection of the Cbz amine protecting group for the facile synthesis of kanamycin A dimers linked at N-300 position[J]. Tetrahedron, 2009, 65, 5922-5927.
[12] Song, G. Q.; Huang, X. F.; Yang, B.; et al. Easy Removal of N-carboxybenzyl (Cbz) Protective Group by Low Carbon Alcohol[J]. Lett. Org. Chem., 2016, 13, 177-180.
[13] Bennasar, M. L.; Roca, T.; Padullés, A. Chemoselective Radical Cleavage of Cbz-Protected Nitrogen Compounds[J]. Org. Lett., 2003, 5, 569-572.

